全球首创双特异性抗体!格菲妥单抗新适应证获批,总生存期翻倍!
小编 2025-04-16
2025年4月14日双特异性抗体药物格菲妥单抗(Glofitamab、高罗华/Columvi)在欧盟获批用于弥漫大B细胞淋巴瘤
据OncLive消息,2025年4月14日,瑞士制药巨头罗氏宣布了重磅喜讯,欧盟委员会(EMA)正式批准格格菲妥单抗联合吉西他滨、奥沙利铂的创新方案,用于复发或难治性弥漫大B细胞淋巴瘤(R/R DLBCL)且无法接受自体干细胞移植(ASCT)成年患者的治疗!
这一批准不仅标志着欧洲首款针对初治后R/R DLBCL的双特异性抗体疗法诞生,更意味着无数在传统治疗中陷入困境的患者,终于等来了改写命运的“生命密钥”。罗氏首席医学官激动表示:“这款疗法的突破,是医学界与癌症博弈的重要里程碑,它将以精准之力撕开R/R DLBCL治疗的新缺口,为患者注入重生的希望”!
▲截图源自“OncLive”
从FDA到NMPA:格菲妥单抗以"全球唯一"身份,改写淋巴瘤治疗格局
2023年7月,格菲妥单抗(Glofitamab,Columvi®、高罗华®)获FDA有条件批准,用于治疗接受过两线及以上系统疗法的复发/难治性弥漫大B细胞淋巴瘤(R/R DLBCL)患者。
同年11月,中国国家药品监督管理局(NMPA)也批准其用于治疗既往接受至少两线系统性治疗的R/R DLBCL成人患者。作为全球首个且目前唯一针对该适应症采用固定周期治疗的双特异性抗体,格菲妥单抗在华上市标志着中国淋巴瘤治疗正式步入双抗新时代!
总生存期提升超1倍!格菲妥单抗显著延长弥漫大B细胞淋巴瘤患者生存期,死亡风险降41%
格菲妥单抗本次新适应症获FDA批准,主要基于一项3期STARGLO临床研究(NCT04408638)的优异数据。该研究纳入274例中位年龄为68岁(58-74岁)的复发或难治性弥漫大B细胞淋巴瘤(R/R DLBCL)患者,均接受过至少一线既往治疗,且不适合移植。入组后将患者随机分为两组,即Glofit-GemOx组(n=183,格菲妥单抗联合吉西他滨+奥沙利铂)、R-GemOx组(n=91,利妥昔单抗+吉西他滨+奥沙利铂)。
结果显示:在初步分析(中位随访11.3个月,95%CI 9.6-12.7)中,Glofit-GemOx组的总生存期显著优于R-GemOx组,中位OS分别为未达到(NE;95%CI 13.8个月-NE) vs 9.0个月(7.3-14.4);死亡风险降低41%(HR 0.59,95%CI 0.40-0.89;p=0.011)。
在最新分析(中位随访20.7个月,95%CI 19.9-23.3)中,Glofit-GemOx组的中位OS达25.5个月(18.3-NE),而R-GemOx组仅为12.9个月(7.9-18.5);风险比进一步验证优势(HR 0.62,95%CI 0.43-0.88)。
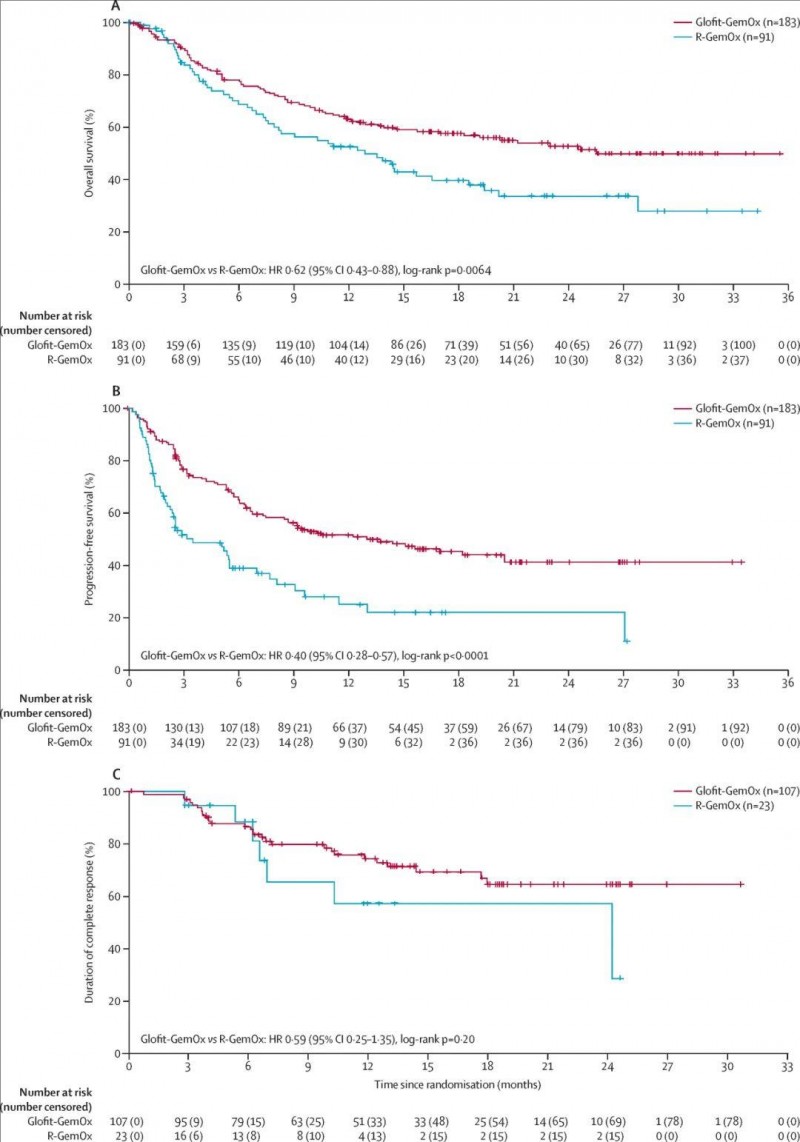
▲图源“The Lancet”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
相信看了上面的数据,淋巴瘤或其他血液肿瘤患者,一定燃起了新的希望!好消息是,目前我国有多款针对淋巴瘤的抗癌新药/新技术,正在开展临床研究,且已有大量患者通过我们抗癌新药招募中心,成功入组接受抗癌新药/新技术的治疗!
想申请抗癌新药临床试验的患者,可将近期病理报告、基因检测报告等资料汇总后,提交至医学部,进行初步评估或了解更多入排标准。
参考资料
[1]Abramson J S,et al.Glofitamab plus gemcitabine and oxaliplatin (GemOx) versus rituximab-GemOx for relapsed or refractory diffuse large B-cell lymphoma (STARGLO): a global phase 3, randomised, open-label trial[J]. The Lancet, 2024, 404(10466): 1940-1954.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(24)01774-4/abstract
[2]https://www.onclive.com/view/glofitamab-plus-chemo-wins-european-approval-for-r-r-dlbcl












